4.6.3. Diagnostica rapida e precoce
Un gruppo internazionale di ricerca formato da ricercatori greci del “Benaki Phytopathological Institute” di Atene e spagnoli del “Instituto Valenciano de Investigaciones Agrarias (IVIA)” di Valencia ha messo a punto un metodo diagnostico rapido, sensibile e affidabile per l’identificazione simultanea dei più importanti viroidi e citoplasmi delle Pomacee, in particolare del melo e del pero.
L’articolo riportante i risultati della ricerca è stato pubblicato ad inizio dicembre su PublMed, rivista on line del “US National Library of Medicine – National Institutes of Health”.
Le Pomaceae sono suscettibili a diverse malattie causate da virus, viroidi e fitoplasmi, trasmesse da piante infette. Una via di diffusione comune è quella dell’impiego di piante infette negli innesti. Fra i patogeni trasmessi in questo modo ci sono:
cancro bolloso del pero (PBCVd – Pear blister canker viroid ), viroide;


Pero affetto da PCVDb)
ulcerazione della mela (ASSVd – Apple scar skin viroid), viroide;

Mela affetta da ASSVd
Crediti immagine: Oregon State University
Candidatus Phytoplasma mali (Ca. P. mali) ovvero l’agente degli scopazzi del melo;

Le foglie malate (a sx) sono più piccole di quelle sane (a dx)
Crediti immagine: EPPO
Candidatus Phytoplasma pyri (Ca. P. pyri) ovvero l’agente della moria del pero.


Pero affetto da Candidatus Phytoplasma
Crediti immagine: L.Giunchedi – Università di Bologna
Nonostante i fitoplasmi sopra citati siano regolamentati in Europa come patogeni da quarantena, non sempre è possibile effettuare analisi complete, veloci ed affidabili.
I ricercatori hanno messo a punto una procedura di analisi basata sulla tecnica RT-qPCR per la rilevazione simultanea di viroidi e fitoplasmi di melo e pero.
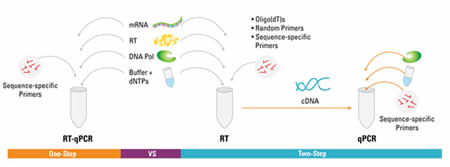
La RT-qPCR è una PCR quantitativa in tempo reale (RT-qPCR, real time quantitative reverse transcription polymerase chain reaction).
La PCR è una tecnica di biologia molecolare che consente la moltiplicazione (amplificazione) di frammenti di acidi nucleici dei quali si conoscano le sequenze nucleotidiche iniziali e terminali. Questa tecnica consente di ottenere in vitro molto rapidamente la quantità di materiale genetico necessaria per le successive applicazioni e/o analisi.
Nel caso di RT-qPCR, la PCR viene accoppiata con un metodo di analisi del DNA: si ha quindi un’amplificazione del DNA e, dopo ogni turno di amplificazione, una sua quantificazione. La tecnica Retro Trascrizionale (RT-PCR) permette di misurare l’espressione relativa di un gene ad un tempo particolare, o in una cellula o in un tipo particolare di tessuto.
Schema di funzionamento della tecnica RT-qPCR
Credi immagine: Thermo Scientific
Per la quantificazione del DNA si usano diverse tecniche basate sull’uso di colorazioni fluorescenti. In particolare, nella procedura messa a punto dai ricercatori greci e spagnoli, per l’identifcazione del DNA si è usata la sonda “TaqMan”. Questa sonda è in grado di contenere due fluorocromi e quindi da il vantaggio di rilevare contemporaneamente più di una sequenza in una sola reazione.
In questo caso specifico la tecnica RT-qPCR con sonda TaqMan permette l’identificazione degli RNA dei viroidi e del DNA dei fitoplasmi nel corso della stessa reazione.
Dai dati ottenuti nel corso delle varie sperimentazioni, il gruppo di ricerca internazionale afferma che la tecnica RT-qPCR messa a punto nel corso di questo studio per la rilevazione simultanea di viroidi e fitoplasmi di melo e pero costituisce uno strumento diagnostico in grado di facilitare i controlli su larga scala sia per la gestione della malattia sia per la propagazione di materiale vivaistico sano certificato.